categorie: Elettricisti alle prime armi, Elettricista industriale
Numero di visite: 37528
Commenti sull'articolo: 0
L'applicazione pratica dell'elettrolisi
Quando una corrente elettrica passa attraverso una soluzione o una fusione di elettrolita, i soluti o altre sostanze che sono prodotti di reazioni secondarie sugli elettrodi vengono rilasciati sugli elettrodi. Questo processo fisico-chimico si chiama elettrolisi.
L'essenza dell'elettrolisi
Nel campo elettrico creato dagli elettrodi, gli ioni nel fluido conduttore entrano in un movimento ordinato. L'elettrodo negativo è il catodo, il positivo è l'anodo.
Gli ioni negativi chiamati anioni (ioni del gruppo ossidrile e residui acidi) si precipitano verso l'anodo e gli ioni positivi chiamati cationi (idrogeno, metallo, ioni ammonio, ecc.) Si precipitano verso il catodo
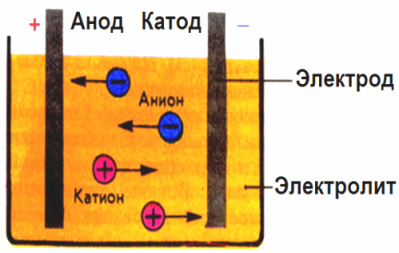
Un processo di riduzione dell'ossidazione ha luogo agli elettrodi: la riduzione elettrochimica delle particelle (atomi, molecole, cationi) avviene al catodo e l'ossidazione elettrochimica delle particelle (atomi, molecole, anioni) avviene all'anodo. Le reazioni di dissociazione in un elettrolita sono reazioni primarie e le reazioni che procedono direttamente agli elettrodi sono chiamate secondarie.
Le leggi dell'elettrolisi di Faraday
La separazione delle reazioni di elettrolisi in primaria e secondaria ha aiutato Michael Faraday a stabilire le leggi dell'elettrolisi:
-
La prima legge dell'elettrolisi di Faraday: la massa della sostanza depositata sull'elettrodo durante l'elettrolisi è direttamente proporzionale alla quantità di elettricità trasferita a questo elettrodo. Per quantità di elettricità si intende una carica elettrica, misurata, di regola, in pendenti.
-
La seconda legge dell'elettrolisi di Faraday: per una data quantità di elettricità (carica elettrica), la massa di un elemento chimico depositato sull'elettrodo è direttamente proporzionale alla massa equivalente dell'elemento. La massa equivalente di una sostanza è la sua massa molare divisa per un numero intero, a seconda della reazione chimica in cui la sostanza è coinvolta.
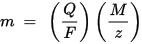
m è la massa della sostanza depositata sull'elettrodo, Q è la carica elettrica totale che passa attraverso la sostanza F = 96.485,33 (83) C mol - 1 è la costante di Faraday, M è la massa molare della sostanza (ad esempio, la massa molare dell'acqua H2O = 18 g / mol), z è il numero di valenza degli ioni di una sostanza (il numero di elettroni per ione).
Si noti che M / z è la massa equivalente della sostanza precipitata. Per la prima legge di Faraday, M, F e z sono costanti, quindi maggiore è il valore di Q, maggiore è il valore di m. Per la seconda legge di Faraday, Q, F e z sono costanti, quindi maggiore è il valore di M / z (massa equivalente), maggiore è il valore di m.
L'elettrolisi è oggi ampiamente utilizzata nell'industria e nella tecnologia. Ad esempio, è l'elettrolisi che serve come uno dei metodi più efficienti per la produzione industriale di idrogeno, perossido di idrogeno, biossido di manganese, alluminio, sodio, magnesio, calcio e altre sostanze. L'elettrolisi viene utilizzata per il trattamento delle acque reflue, nella galvanica, nella galvanica e infine nelle fonti di corrente chimica. Ma prima le cose.
Ottenere metalli puri dai minerali per elettrolisi
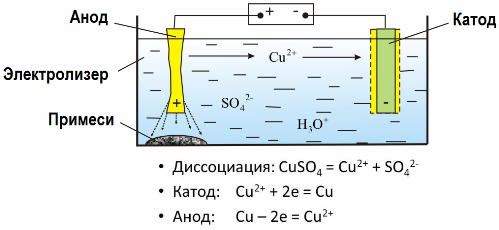
Grazie all'elettrolisi, molti metalli vengono estratti dai minerali e sottoposti a ulteriore elaborazione. Quindi, quando il minerale o il minerale arricchito - concentrato - viene trattato con reagenti, il metallo passa nella soluzione, quindi il metallo viene estratto dalla soluzione mediante elettroestrazione. Il metallo puro viene rilasciato contemporaneamente al catodo. In questo modo ricevere zinco, rame, cadmio.
I metalli sono sottoposti a elettrofinitura per eliminare le impurità e convertire le impurità contenute in una forma conveniente per ulteriori elaborazioni. Il metallo da pulire viene fuso sotto forma di piastre e queste piastre vengono utilizzate come anodi nell'elettrolisi.
Quando la corrente passa, il metallo dell'anodo si dissolve, passa sotto forma di cationi nella soluzione, quindi i cationi vengono scaricati sul catodo e formano un precipitato di metallo puro. Le impurità dell'anodo non si dissolvono: precipitano con il liquame dell'anodo o passano nell'elettrolito, da dove vengono rimosse continuamente o periodicamente.
Considera come esempio elettrofinitura di rame. Il componente principale della soluzione - solfato di rame - il sale più comune ed economico di questo metallo. La soluzione ha una bassa conduttività elettrica. Per aumentarlo, l'acido solforico viene aggiunto all'elettrolita.
Inoltre, nella soluzione vengono introdotte piccole quantità di additivi per facilitare la formazione di un precipitato di metallo compatto. In generale, rame, nichel, piombo, stagno, argento e oro sono soggetti a raffinazione elettrolitica.
Trattamento delle acque reflue di elettrolisi
L'elettrolisi viene utilizzata nel trattamento delle acque reflue (processi di elettrocoagulazione, elettroestrazione ed elettroflotazione). Il metodo di pulizia elettrochimico è uno dei più comunemente usati. Per l'elettrolisi vengono utilizzati anodi insolubili (magnetite, ossido di piombo, grafite, manganese, che si depositano su una base di titanio) o solubili (alluminio, ferro).
Questo metodo viene utilizzato per isolare dall'acqua sostanze organiche e inorganiche tossiche. Ad esempio, i tubi di rame vengono puliti di scala con una soluzione di acido solforico e le acque reflue industriali devono quindi essere pulite mediante elettrolisi con un anodo insolubile. Il rame viene rilasciato nel catodo, che può essere nuovamente utilizzato nella stessa impresa.
Le acque reflue alcaline vengono purificate per elettrolisi dai composti del cianuro. Al fine di accelerare l'ossidazione dei cianuri, aumentare la conduttività elettrica e risparmiare energia, nell'acqua viene utilizzato un additivo sotto forma di cloruro di sodio.
L'elettrolisi viene eseguita con un anodo di grafite e un catodo in acciaio. I cianuri vengono distrutti durante l'ossidazione elettrochimica e il cloro, che viene rilasciato sull'anodo. L'efficacia di tale pulizia è vicina al 100%.
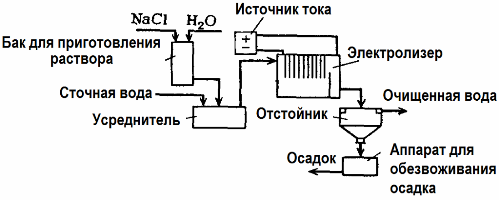
Oltre alla pulizia elettrochimica diretta, può essere incluso nel processo di elettrolisi coagulazione. Escludendo l'aggiunta di sali, l'elettrolisi viene eseguita con alluminio solubile o anodi di ferro. Quindi non solo i contaminanti sull'anodo vengono distrutti, ma l'anodo stesso si dissolve. Si formano composti dispersi attivi che coagulano (addensano) contaminanti dispersi colloidali.
Questo metodo è efficace nel trattamento delle acque reflue da grassi, prodotti petroliferi, coloranti, oli, sostanze radioattive, ecc. Si chiama elettrocoagulazione.
zincatura
La galvanica è la deposizione elettrolitica di alcuni metalli al fine di proteggere i prodotti dalla corrosione e conferire loro un aspetto estetico adeguato (il rivestimento è realizzato con cromo, nichel, argento, oro, platino, ecc.). La cosa viene accuratamente pulita, sgrassata e utilizzata come catodo in un bagno elettrolitico in cui viene versata una soluzione salina del metallo con cui è necessario rivestire il prodotto.
Una piastra dello stesso metallo viene utilizzata come anodo. Di norma, viene utilizzata una coppia di piastre anodiche e il soggetto da galvanizzare viene posizionato tra di esse.
galvanoplastica
Galvanotecnica - la deposizione di metallo sulla superficie di diversi corpi per riprodurre le loro forme: stampi per parti in fusione, sculture, cliché stampati, ecc.

La deposizione galvanica di metallo sulla superficie di un oggetto è possibile solo quando questa superficie o l'intero oggetto è un conduttore di corrente elettrica, quindi è consigliabile utilizzare i metalli per realizzare modelli o forme. I metalli fusibili sono i più adatti a questo scopo: piombo, stagno, saldature, leghe di legno.
Questi metalli sono morbidi, facilmente lavorabili con strumenti di metallo, sono ben incisi e colati. Dopo aver costruito lo strato galvanico e rifinito, lo stampo metallico viene fuso dal prodotto finito.
Tuttavia, le maggiori opportunità per la fabbricazione di modelli sono ancora rappresentate dai materiali dielettrici. Per metallizzare tali modelli, è necessario fornire la loro conducibilità elettrica superficiale. Il successo o il fallimento alla fine dipende principalmente dalla qualità dello strato conduttivo. Questo livello può essere applicato in tre modi.
Il modo più comune è grafitirovanie, è adatto per modelli di plastilina e altri materiali che consentono la molatura della grafite sulla superficie.
Il prossimo trucco è abbronzante, il metodo è buono per i modelli di forma relativamente complessa, per materiali diversi, tuttavia, a causa dello spessore dello strato di bronzo, il trasferimento di piccole parti è alquanto distorto.
E infine argentaturaadatto in tutti i casi, ma soprattutto indispensabile per i modelli fragili con una forma molto complessa - piante, insetti, ecc.
Fonti di corrente chimica
Inoltre, l'elettrolisi è il processo principale grazie al quale funzionano le più avanzate fonti di corrente chimica, come batterie e accumulatori. Ci sono due elettrodi a contatto con l'elettrolito.
Viene stabilita una differenza potenziale tra gli elettrodi: una forza elettromotrice corrispondente all'energia libera della reazione redox. Vedi qui per maggiori dettagli: Fonti chimiche di corrente elettrica
Batteria al limone (clicca sull'immagine per ingrandire)
L'azione delle fonti di corrente chimica si basa sulla presenza di processi spazialmente separati con un circuito esterno chiuso: sull'anodo negativo, l'agente riducente viene ossidato, gli elettroni liberi che si formano passano attraverso il circuito esterno al catodo positivo, creando una corrente di scarica, dove partecipano alla reazione di riduzione dell'ossidazione. Pertanto, il flusso di elettroni carichi negativamente lungo il circuito esterno va dall'anodo al catodo, cioè dall'elettrodo negativo al positivo.
Vedi anche su electro-it.tomathouse.com
: