categorie: Articoli in vetrina » Elettricisti alle prime armi
Numero di visite: 36288
Commenti sull'articolo: 1
Fonti di corrente chimica: caratteristiche principali
 Per più di due secoli, l'umanità ha utilizzato l'energia delle reazioni chimiche tra varie sostanze per produrre corrente continua.
Per più di due secoli, l'umanità ha utilizzato l'energia delle reazioni chimiche tra varie sostanze per produrre corrente continua.
Principio di funzionamento
La reazione redox che si verifica tra le sostanze con le proprietà di un agente ossidante e un agente riducente è accompagnata dal rilascio di elettroni, il cui movimento forma una corrente elettrica. Tuttavia, per utilizzare la sua energia, è necessario creare le condizioni per il passaggio degli elettroni attraverso un circuito esterno; in caso contrario, viene rilasciato dal calore da una semplice miscela di un agente ossidante e un agente riducente.
Pertanto, tutte le fonti di corrente chimica hanno due elettrodi:
-
l'anodo su cui si verifica l'ossidazione;
-
catodo che effettua la riduzione di una sostanza.
Gli elettrodi a distanza sono collocati in una nave con un elettrolita - una sostanza che conduce corrente elettrica a causa dei processi di dissociazione del mezzo in ioni.
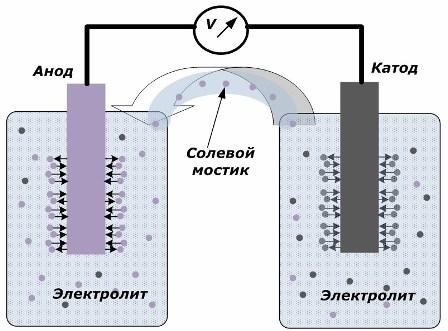
Il principio di convertire l'energia chimica in energia elettrica
La figura mostra che gli elettrodi sono posizionati in recipienti separati collegati da un ponte salino attraverso il quale viene creato il movimento degli ioni lungo il circuito interno. Quando i circuiti esterno e interno sono aperti, si verificano due processi sugli elettrodi: la transizione degli ioni dal metallo dell'elettrodo all'elettrolita e la transizione degli ioni dall'elettrolita al reticolo cristallino degli elettrodi.
Le portate di questi processi sono le stesse e i potenziali di tensione di segni opposti si accumulano su ciascun elettrodo. Se sono collegati attraverso un ponte salino e viene applicato un carico, si verificherà un circuito elettrico. Una corrente interna è generata dal movimento di ioni tra gli elettrodi attraverso l'elettrolita e il ponte salino. Il movimento di elettroni lungo il circuito esterno nella direzione dall'anodo al catodo.
Quasi tutte le reazioni redox sono accompagnate dalla generazione di elettricità. Ma il suo valore dipende da molti fattori, inclusi i volumi e le masse delle sostanze chimiche utilizzate, i materiali utilizzati per produrre gli elettrodi, come l'elettrolito, la concentrazione di ioni, il design.
Le più utilizzate nelle moderne fonti di corrente chimica sono:
-
per il materiale dell'anodo (agente riducente), zinco (Zn), piombo (Pb), cadmio (Cd) e alcuni altri metalli;
-
per il materiale catodico (ossidante) - ossido di piombo PbO2, ossido di manganese MnO2, idrossido di nichel NiOOH e altri;
-
elettroliti a base di soluzioni di acidi, alcali o sali.
Metodi di classificazione
Una parte delle fonti di energia chimica può essere riutilizzata, mentre l'altra no. Questo principio è preso come base per la loro classificazione.
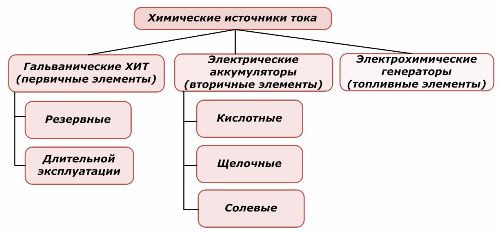
Classificazione degli elementi chimici
Forza elettromotrice celle galvaniche, a seconda del progetto, raggiunge 1,2 ÷ 1,5 volt. Per ottenere valori elevati, vengono combinati in batterie, collegandosi in serie. Quando le batterie sono collegate in parallelo, la corrente e la potenza aumentano.
È generalmente accettato che le fonti di corrente chimica primaria non supportano la ricarica, sebbene più precisamente questa posizione possa essere formulata in modo diverso: la sua attuazione non è economicamente fattibile.
Le fonti ridondanti di corrente chimica primaria sono immagazzinate in uno stato in cui l'elettrolita è isolato dagli elettrodi. Ciò elimina il verificarsi della reazione redox e garantisce la disponibilità per la messa in servizio. Non vengono riutilizzati. La durata di conservazione delle fonti di energia chimiche di riserva è limitata a 10-15 anni.
Le batterie vengono ricaricate correttamente dall'applicazione di energia elettrica esterna. Grazie a questa funzione, sono chiamati fonti di corrente secondarie. Sono in grado di resistere a centinaia e migliaia di cicli di scarica-scarica.L'EMF della batteria può essere nell'intervallo di 1,0 ÷ 1,5 volt. Sono anche combinati in batterie.
I generatori elettrochimici lavorano sul principio delle celle galvaniche, ma per eseguire la reazione elettrochimica, le sostanze provengono dall'esterno e tutti i prodotti rilasciati vengono rimossi dall'elettrolito. Ciò ti consente di organizzare un processo continuo.
Principali caratteristiche prestazionali delle fonti energetiche chimiche
1. La tensione attraverso i terminali aperti
A seconda del design, una singola fonte può creare solo una certa differenza potenziale. Per l'uso in dispositivi elettrici, sono combinati in batterie.
2. Capacità specifica
Per un certo tempo (in ore) una sorgente di corrente chimica può generare una quantità limitata di corrente (in ampere), che sono attribuiti a un'unità di peso o volume.
3. Densità di potenza
Caratterizza la capacità di un'unità di peso o volume di una sorgente di corrente chimica di generare energia generata dal prodotto di tensione per intensità di corrente.
4. Durata dell'operazione
Questo parametro è anche chiamato data di scadenza.
5. Il valore delle correnti di autoscarica
Questi processi laterali di reazioni elettrochimiche portano al consumo della massa attiva degli elementi, causano corrosione e riducono la capacità specifica.
6. Prezzo del prodotto
Dipende dal design, dai materiali utilizzati e da una serie di altri fattori.
Le migliori fonti di corrente chimica sono quelle con valori elevati dei primi quattro parametri e l'autoscarica e i costi sono bassi.
Principi di carica della batteria
Tra le fonti di corrente chimiche secondarie, stanno guadagnando grande popolarità. modelli agli ioni di litio, che sono stati ampiamente utilizzati per alimentare dispositivi elettronici. Usano LiMO2 (M Co, Ni, Mn) come materiale dell'elettrodo positivo e la grafite come negativo.
Quando caricati, gli ioni di litio dall'energia esterna applicata vengono rilasciati dal metallo catodico, passano attraverso l'elettrolita e penetrano nello spazio tra gli strati di grafite, accumulandosi lì.
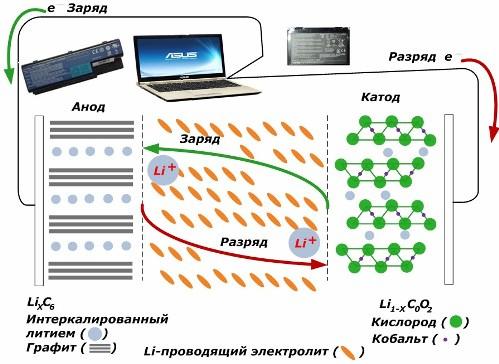
Quando l'energia caricabatteria è assente e il carico è collegato agli elettrodi, quindi gli ioni di litio nell'elettrolita si muovono nella direzione opposta.
Se la carica e la scarica non vengono eseguite, l'energia della batteria non viene consumata, ma immagazzinata. Ma la sua quantità è limitata dalle proprietà dei materiali utilizzati. Ad esempio, nelle batterie agli ioni di litio, la capacità elettrica specifica è di 130 ÷ 150 mAh / g. È limitato dalle proprietà del materiale anodico. Per la grafite, la capacità è circa due volte superiore.
Gli scienziati sono ora alla ricerca di modi per aumentare la capacità della batteria, stanno esplorando la possibilità di utilizzare una reazione chimica tra litio e ossigeno nell'aria. Per fare ciò, i progetti sono sviluppati con un catodo ad aria non consumabile, utilizzato in batterie separate. Questo metodo può aumentare la densità di energia fino a 10 volte.
Il funzionamento di fonti di corrente chimica richiede conoscenza fondamenti di ingegneria elettrica, elettrochimica, scienza dei materiali e fisica dello stato solido.
Vedi anche su electro-it.tomathouse.com
:
