categorie: Articoli in vetrina » Notizie elettriche interessanti
Numero di visite: 51203
Commenti sull'articolo: 7
Cosa sono le celle a combustibile
 L'elettronica mobile ogni anno, se non un mese, sta diventando sempre più accessibile e diffusa. Qui hai laptop, PDA, fotocamere digitali e telefoni cellulari e una tonnellata di dispositivi utili e non così tanti. E tutti questi dispositivi acquisiscono continuamente nuove funzionalità, processori più potenti, schermi a colori di grandi dimensioni, comunicazioni wireless, riducendo allo stesso tempo le dimensioni. Ma, a differenza delle tecnologie a semiconduttore, le tecnologie di potenza di tutto questo serraglio mobile non vanno a passi da gigante.
L'elettronica mobile ogni anno, se non un mese, sta diventando sempre più accessibile e diffusa. Qui hai laptop, PDA, fotocamere digitali e telefoni cellulari e una tonnellata di dispositivi utili e non così tanti. E tutti questi dispositivi acquisiscono continuamente nuove funzionalità, processori più potenti, schermi a colori di grandi dimensioni, comunicazioni wireless, riducendo allo stesso tempo le dimensioni. Ma, a differenza delle tecnologie a semiconduttore, le tecnologie di potenza di tutto questo serraglio mobile non vanno a passi da gigante.
Le batterie ricaricabili convenzionali e le batterie non sono chiaramente sufficienti per alimentare gli ultimi risultati dell'industria elettronica per un periodo di tempo considerevole. E senza batterie affidabili e capienti, si perde l'intero significato di mobilità e wireless. Quindi l'industria dei computer sta lavorando sempre più attivamente al problema alimentatori alternativi. E la direzione più promettente, oggi, è celle a combustibile.
Il principio di base del funzionamento delle celle a combustibile fu scoperto dallo scienziato britannico Sir William Grove nel 1839. È noto come il padre della cella a combustibile. William Grove ha generato elettricità cambiando elettrolisi dell'acqua per estrarre idrogeno e ossigeno. Dopo aver scollegato la batteria dalla cella elettrolitica, Grove fu sorpresa di scoprire che gli elettrodi iniziarono ad assorbire il gas rilasciato e generare corrente. Apertura del processo combustione elettrochimica a freddo dell'idrogeno un evento nel settore energetico è diventato significativo e in futuro elettrochimici noti come Ostwald e Nernst hanno svolto un ruolo importante nello sviluppo delle basi teoriche e nell'implementazione pratica delle celle a combustibile e hanno previsto un grande futuro per loro.
se stesso il termine "cella a combustibile" (Cella a combustibile) apparve in seguito - fu proposto nel 1889 da Ludwig Mond e Charles Langer, che cercarono di creare un dispositivo per la generazione di elettricità dall'aria e dal gas di carbone.
Durante la normale combustione, l'ossigeno ossida i combustibili fossili e l'energia chimica del combustibile viene convertita in modo inefficace in energia termica. Ma si è scoperto che è possibile eseguire la reazione di ossidazione, ad esempio idrogeno con ossigeno, in un mezzo elettrolitico e in presenza di elettrodi per ottenere una corrente elettrica. Ad esempio, fornendo idrogeno ad un elettrodo situato in un mezzo alcalino, otteniamo elettroni:
2H2 + 4OH- → 4H2O + 4e-
che, passando attraverso un circuito esterno, vanno all'elettrodo opposto, a cui entra l'ossigeno e dove avviene la reazione: 4e- + O2 + 2H2O → 4OH-
Si può vedere che la risultante reazione 2H2 + O2 → H2O è la stessa della combustione normale, ma nella cella a combustibile, o altrimenti, in generatore elettrochimico, risulta corrente elettrica con alta efficienza e parzialmente calore. Si noti che carbone, monossido di carbonio, alcoli, idrazina, altre sostanze organiche possono anche essere usati come combustibile nelle celle a combustibile e aria, acqua ossigenata, cloro, bromo, acido nitrico, ecc. possono essere usati come agenti ossidanti.
Lo sviluppo delle celle a combustibile è proseguito vigorosamente sia all'estero che in Russia, e ulteriormente in URSS. Tra gli scienziati che hanno dato un grande contributo allo studio delle celle a combustibile, citiamo V. Zhako, P. Yablochkov, F. Bacon, E. Bauer, E. Justi, K. Cordes. A metà del secolo scorso, iniziò un nuovo assalto ai problemi delle celle a combustibile. Ciò è in parte dovuto alla nascita di nuove idee, materiali e tecnologie come risultato della ricerca sulla difesa.
Uno degli scienziati che ha fatto un passo importante nello sviluppo delle celle a combustibile è stato P. M. Spiridonov. Elementi di idrogeno-ossigeno di Spiridonov ha dato una densità di corrente di 30 mA / cm2, che a quel tempo era considerata un grande risultato.Negli anni Quaranta, O. Davtyan creò un impianto per la combustione elettrochimica del gas generatore ottenuto dalla gassificazione del carbone. Con ogni metro cubo di volume di elementi, Davtyan riceveva 5 kW di potenza.
Quello era prima cella a combustibile a elettrolita solido. Aveva un'alta efficienza, ma col tempo l'elettrolita divenne inutilizzabile e doveva essere sostituito. Successivamente, alla fine degli anni cinquanta, Davtyan creò una potente installazione che spinse il trattore. In quegli stessi anni, l'ingegnere inglese T. Bacon progettò e costruì una batteria a celle a combustibile con una capacità totale di 6 kW e un'efficienza dell'80%, funzionando con idrogeno e ossigeno puri, ma il rapporto tra potenza e peso della batteria era troppo piccolo - tali elementi non erano adatti per un uso pratico e anche cari.
Negli anni successivi è passato il tempo dei solitari. I creatori di veicoli spaziali si interessarono alle celle a combustibile. Dalla metà degli anni '60, milioni di dollari sono stati investiti nella ricerca sulle celle a combustibile. Il lavoro di migliaia di scienziati e ingegneri ha permesso di raggiungere un nuovo livello e nel 1965. le celle a combustibile furono testate negli Stati Uniti sull'astronave Gemini 5, e successivamente sulle navi Apollo per i voli sulla Luna e nell'ambito del programma Shuttle.
In URSS, le celle a combustibile sono state sviluppate presso NPO Kvant, anche per l'uso nello spazio. In quegli anni sono già comparsi nuovi materiali - elettroliti polimerici solidi basati su membrane a scambio ionico, nuovi tipi di catalizzatori, elettrodi. Eppure, la densità di corrente di lavoro era piccola - nell'intervallo 100-200 mA / cm2 e il contenuto di platino sugli elettrodi era di diversi g / cm2. Ci sono stati molti problemi associati a durabilità, stabilità e sicurezza.
La fase successiva del rapido sviluppo delle celle a combustibile è iniziata negli anni '90. il secolo scorso e continua ora. È causato dalla necessità di nuove fonti energetiche efficienti in relazione, da un lato, al problema ambientale globale della crescente emissione di gas a effetto serra dalla combustione di combustibili fossili e, dall'altro, con l'esaurimento di tali combustibili. Poiché l'acqua è il prodotto finale della combustione dell'idrogeno in una cella a combustibile, sono considerati i più puliti dal punto di vista dell'impatto ambientale. Il problema principale è solo trovare un modo efficace ed economico per produrre idrogeno.
Miliardi di investimenti finanziari nello sviluppo di celle a combustibile e generatori di idrogeno dovrebbero portare a una svolta tecnologica e rendere il loro uso nella vita di tutti i giorni una realtà: nelle celle dei telefoni cellulari, nelle automobili, nelle centrali elettriche. Già giganti automobilistici come Ballard, Honda, Daimler Chrysler e General Motors stanno già dimostrando auto e autobus con celle a combustibile da 50 kW. Diverse aziende si sono sviluppate impianti dimostrativi di celle a combustibile a elettrolita solido fino a 500 kW. Ma, nonostante un importante passo avanti nel miglioramento delle prestazioni delle celle a combustibile, molti problemi devono ancora essere risolti in relazione al loro costo, affidabilità e sicurezza.
In una cella a combustibile, a differenza di batterie e accumulatori, sia il combustibile che l'ossidante vengono forniti dall'esterno. La cella a combustibile è solo un mediatore nella reazione e in condizioni ideali potrebbe funzionare quasi per sempre. La bellezza di questa tecnologia è quella infatti, il combustibile viene bruciato nell'elemento e l'energia rilasciata viene direttamente convertita in elettricità. Con la combustione diretta del combustibile, viene ossidato dall'ossigeno e il calore generato in questo processo viene utilizzato per completare il lavoro utile.
In una cella a combustibile, come nelle batterie, le reazioni di ossidazione del carburante e riduzione dell'ossigeno sono spazialmente separate e il processo di "combustione" procede solo se la cella emette corrente al carico. È come generatore diesel, solo senza diesel e generatore. E anche senza fumo, rumore, surriscaldamento e con efficienza molto più elevata. Quest'ultimo è spiegato dal fatto che, in primo luogo, non ci sono dispositivi meccanici intermedi e, in secondo luogo, la cella a combustibile non è un motore termico e quindi non obbedisce alla legge di Carnot (ovvero, la sua efficienza non è determinata dalla differenza di temperatura).
L'ossigeno viene utilizzato come agente ossidante nelle celle a combustibile. Inoltre, poiché l'ossigeno è abbastanza nell'aria, non è necessario preoccuparsi della fornitura di un agente ossidante. Per quanto riguarda il carburante, è idrogeno. Quindi, la reazione si verifica nella cella a combustibile:
2H2 + O2 → 2H2O + elettricità + calore.
Il risultato è energia utile e vapore acqueo. Il più semplice nel suo design è cella a combustibile a membrana a scambio protonico (vedi figura 1). Funziona come segue: l'idrogeno che entra nell'elemento si decompone sotto l'azione del catalizzatore in elettroni e ioni idrogeno H + caricati positivamente. Quindi entra in gioco una membrana speciale, che funge da elettrolita in una batteria convenzionale. A causa della sua composizione chimica, passa i protoni attraverso se stesso, ma intrappola gli elettroni. Pertanto, gli elettroni accumulati sull'anodo creano una carica negativa in eccesso e gli ioni idrogeno creano una carica positiva sul catodo (la tensione sull'elemento è di circa 1 V).
Per creare alta potenza, una cella a combustibile è assemblata da una pluralità di celle. Se si include un elemento nel carico, gli elettroni fluiscono attraverso di esso fino al catodo, creando una corrente e completando il processo di ossidazione dell'idrogeno da parte dell'ossigeno. Come catalizzatore in tali celle a combustibile, vengono tipicamente utilizzate microparticelle di platino depositate su una fibra di carbonio. Grazie alla sua struttura, un tale catalizzatore passa bene gas ed elettricità. La membrana è tipicamente costituita da un polimero Nafion contenente zolfo. Lo spessore della membrana è pari a decimi di millimetro. Durante la reazione, naturalmente, viene rilasciato anche calore, ma non è così tanto, quindi la temperatura operativa viene mantenuta nell'intervallo 40-80 ° C.
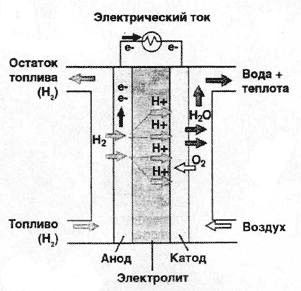
Fig. 1 Il principio di funzionamento della cella a combustibile
Esistono altri tipi di celle a combustibile, che differiscono principalmente per il tipo di elettrolita utilizzato. Quasi tutti richiedono l'idrogeno come combustibile, quindi sorge una domanda logica: dove trovarlo. Naturalmente, sarebbe possibile utilizzare idrogeno compresso dai cilindri, ma immediatamente ci sono problemi associati al trasporto e allo stoccaggio di questo gas altamente infiammabile ad alta pressione. Naturalmente, puoi usare l'idrogeno in forma legata come nelle batterie agli idruri metallici. Tuttavia, resta il compito della sua estrazione e trasporto, perché non esiste l'infrastruttura delle stazioni di rifornimento di idrogeno.
Tuttavia, esiste anche una soluzione: il combustibile liquido a base di idrocarburi può essere utilizzato come fonte di idrogeno. Ad esempio, alcol etilico o metilico. È vero, qui è già necessario uno speciale dispositivo aggiuntivo: un convertitore di carburante, che converte gli alcoli in una miscela di H2 gassoso e CO2 ad alta temperatura (per il metanolo sarà da qualche parte intorno ai 240 ° C). Ma in questo caso è già più difficile pensare alla portabilità: tali dispositivi sono ben usati come fissi o alternatori di autoMa per le apparecchiature mobili compatte hai bisogno di qualcosa di meno ingombrante.
E qui arriviamo a quel dispositivo, lo sviluppo del quale quasi tutti i più grandi produttori di elettronica sono impegnati con una forza terribile - cella a combustibile a metanolo (figura 2).
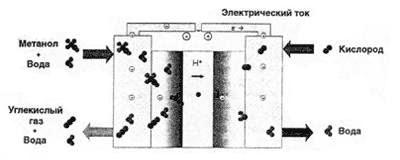
Fig.2 Il principio di funzionamento della cella a combustibile sul metanolo
La differenza fondamentale tra l'idrogeno e gli elementi di riempimento del metanolo è il catalizzatore utilizzato. Il catalizzatore nella cella a combustibile a metanolo consente di rimuovere i protoni direttamente dalla molecola di alcol.Pertanto, il problema del carburante viene risolto: l'alcool metilico è prodotto in serie per l'industria chimica, è facile da conservare e trasportare e per caricare una cella a combustibile a metanolo, è sufficiente sostituire semplicemente la cartuccia con carburante. È vero, c'è un aspetto negativo: il metanolo è tossico. Inoltre, l'efficienza di una cella a combustibile a metanolo è significativamente inferiore a quella di una a idrogeno.

Fig. 3. Cella a combustibile a metanolo
L'opzione più allettante è quella di utilizzare l'alcol etilico come combustibile, poiché la produzione e la distribuzione di bevande alcoliche di qualsiasi composizione e forza è ben consolidata in tutto il mondo. Tuttavia, l'efficienza delle celle a combustibile a base di etanolo, purtroppo, è persino inferiore a quella del metanolo.
Come già notato in molti anni di sviluppo nel campo delle celle a combustibile, sono stati costruiti vari tipi di celle a combustibile. Le celle a combustibile sono classificate per elettrolita e tipo di combustibile.
1. Elettrolita idrogeno-ossigeno polimerico solido.
2. Celle a combustibile a metanolo polimerico solido.
3. Elementi sull'elettrolita alcalino.
4. Celle a combustibile ad acido fosforico.
5. Celle a combustibile su carbonati fusi.
6. Celle a combustibile ad ossido solido.
Idealmente, l'efficienza delle celle a combustibile è molto elevata, ma in condizioni reali ci sono perdite associate a processi di non equilibrio, come perdite ohmiche dovute alla conduttività dell'elettrolita e degli elettrodi, polarizzazione di attivazione e concentrazione, perdite di diffusione. Di conseguenza, parte dell'energia generata nelle celle a combustibile viene convertita in calore. Gli sforzi degli specialisti mirano a ridurre queste perdite.
La principale fonte di perdite ohmiche, nonché il motivo dell'elevato prezzo delle celle a combustibile, sono le membrane per lo scambio di ioni solfocazione perfluorurate. Ora stiamo cercando polimeri alternativi a conduzione protonica più economici. Poiché la conducibilità di queste membrane (elettroliti solidi) raggiunge un valore accettabile (10 Ohm / cm) solo in presenza di acqua, i gas forniti alla cella a combustibile devono essere ulteriormente inumiditi in un dispositivo speciale, il che rende anche il sistema più costoso. Negli elettrodi di diffusione del gas catalitico vengono utilizzati principalmente platino e alcuni altri metalli nobili, e finora non è stata trovata alcuna sostituzione. Sebbene il contenuto di platino nelle celle a combustibile sia di diversi mg / cm2, per batterie di grandi dimensioni la sua quantità raggiunge decine di grammi.
Durante la progettazione di celle a combustibile, viene prestata molta attenzione al sistema di rimozione del calore, poiché ad alte densità di corrente (fino a 1A / cm2) il sistema si surriscalda da solo. Per il raffreddamento, viene utilizzata l'acqua che circola nella cella a combustibile attraverso canali speciali e, a basse capacità, viene utilizzato il soffiaggio dell'aria.
Quindi, il moderno sistema del generatore elettrochimico, oltre alla stessa batteria a celle a combustibile, "cresce" con molti dispositivi ausiliari, come: pompe, compressore per l'alimentazione dell'aria, ingresso di idrogeno, umidificatore a gas, unità di raffreddamento, sistema di controllo delle perdite di gas, convertitore da CC a CA, processore di controllo ecc. Tutto ciò porta al fatto che il costo del sistema di celle a combustibile nel periodo 2004-2005 era di 2-3 mila $ / kW. Secondo gli esperti, le celle a combustibile saranno disponibili per l'uso nei trasporti e nelle centrali elettriche fisse al prezzo di 50-100 $ / kW.
Per l'introduzione delle celle a combustibile nella vita di tutti i giorni, insieme ai componenti più economici, devi aspettarti nuove idee e approcci originali. In particolare, grandi speranze sono associate all'uso di nanomateriali e nanotecnologie. Ad esempio, recentemente diverse aziende hanno annunciato la creazione di catalizzatori super efficienti, in particolare, per un elettrodo di ossigeno basato su gruppi di nanoparticelle di vari metalli. Inoltre, sono stati segnalati progetti di celle a combustibile prive di membrana in cui viene fornito combustibile liquido (ad esempio metanolo) alla cella a combustibile insieme a un agente ossidante.Un concetto interessante è il concetto sviluppato di elementi di biocarburanti che operano in acque inquinate e consumano ossigeno disciolto come agente ossidante e impurità organiche come combustibile.
Secondo gli esperti, le celle a combustibile entreranno nel mercato di massa nei prossimi anni. In effetti, gli sviluppatori affrontano i problemi tecnici uno dopo l'altro, riferiscono dei successi e presentano prototipi di celle a combustibile. Ad esempio, Toshiba ha dimostrato un prototipo di cella a combustibile a metanolo finito. Ha una dimensione di 22x56x4,5 mm e fornisce una potenza dell'ordine di 100mW. Un rifornimento in 2 cubetti di metanolo concentrato (99,5%) è sufficiente per 20 ore di lavoro del lettore MP3. Toshiba ha rilasciato una pila a combustibile commerciale per alimentare i telefoni cellulari. Ancora una volta, lo stesso Toshiba ha dimostrato un elemento per l'alimentazione dei laptop che misura 275x75x40mm, consentendo al computer di funzionare per 5 ore da un singolo rifornimento di carburante.
Un'altra società giapponese, Fujitsu, non è molto indietro rispetto a Toshiba. Nel 2004, ha anche introdotto un elemento che agisce su una soluzione acquosa al 30% di metanolo. Questa cella a combustibile ha funzionato in un rifornimento di carburante in 300 ml per 10 ore e allo stesso tempo ha prodotto una potenza di 15 watt.
Casio sta sviluppando una cella a combustibile in cui il metanolo viene prima trasformato in una miscela di H2 gassoso e CO2 in un convertitore di carburante in miniatura, quindi immesso nella cella a combustibile. Durante la dimostrazione, il prototipo Casio ha fornito energia al laptop per 20 ore.
Samsung è stato anche notato nel campo delle celle a combustibile: nel 2004 ha dimostrato il suo prototipo da 12 W progettato per alimentare un laptop. In generale, Samsung prevede di utilizzare celle a combustibile, principalmente negli smartphone di quarta generazione.
Devo dire che le società giapponesi in genere hanno affrontato molto attentamente lo sviluppo delle celle a combustibile. Nel 2003, aziende come Canon, Casio, Fujitsu, Hitachi, Sanyo, Sharp, Sony e Toshiba hanno unito le forze per sviluppare uno standard comune per celle a combustibile per laptop, telefoni cellulari, PDA e altri dispositivi elettronici. Le compagnie americane, che sono anche numerose in questo mercato, lavorano principalmente sotto contratto con i militari e sviluppano celle a combustibile per elettrizzare i soldati americani.
I tedeschi non sono molto indietro: Smart Fuel Cell vende celle a combustibile per alimentare un ufficio mobile. Il dispositivo si chiama Smart Fuel Cell C25, ha dimensioni di 150x112x65mm e può produrre fino a 140 watt-ora in una singola stazione di servizio. Questo è sufficiente per alimentare il laptop per circa 7 ore. Quindi la cartuccia può essere sostituita e puoi continuare a lavorare. La dimensione della cartuccia con metanolo è di 99x63x27 mm e pesa 150 g. Il sistema stesso pesa 1,1 kg, quindi non lo si può chiamare portatile, ma è comunque un dispositivo completo e conveniente. La società sta inoltre sviluppando un modulo di alimentazione per l'alimentazione di videocamere professionali.
In generale, le celle a combustibile sono quasi entrate nel mercato dell'elettronica mobile. I produttori sono lasciati a risolvere gli ultimi problemi tecnici prima di iniziare la produzione di massa.
Innanzitutto, è necessario risolvere il problema della miniaturizzazione delle celle a combustibile. Dopotutto, più piccola è la cella a combustibile, minore è la potenza che sarà in grado di erogare, quindi vengono costantemente sviluppati nuovi catalizzatori ed elettrodi che consentono, a dimensioni ridotte, di massimizzare la superficie di lavoro. Qui, appena in tempo, gli ultimi sviluppi nel campo della nanotecnologia e dei nanomateriali (ad esempio i nanotubi) sono utili. Ancora una volta, per miniaturizzare la reggiatura di elementi (pompe per carburante e acqua, sistemi di raffreddamento e conversioni di carburante), i progressi microelettromeccanici vengono sempre più applicati.
Il secondo importante problema che deve essere affrontato è il prezzo. In effetti, come catalizzatore nella maggior parte delle celle a combustibile, viene utilizzato platino molto costoso.Ancora una volta, alcuni produttori stanno cercando di sfruttare al meglio la tecnologia del silicio già ben sviluppata.
Per quanto riguarda le altre aree di utilizzo delle celle a combustibile, le celle a combustibile sono già ben consolidate lì, sebbene non siano ancora diventate mainstream nel settore energetico o nei trasporti. Molte case automobilistiche hanno già presentato le loro concept car alimentate a celle a combustibile. In diverse città del mondo, circolano autobus a celle a combustibile. Canadian Ballard Power Systems produce una gamma di generatori stazionari che vanno da 1 a 250 kW. Allo stesso tempo, i generatori di chilowatt sono progettati per fornire immediatamente un appartamento con elettricità, calore e acqua calda.
Vedi anche: Fonti di energia alternative
Vedi anche su electro-it.tomathouse.com
:
