categorie: Articoli in vetrina » Elettricisti alle prime armi
Numero di visite: 70526
Commenti sull'articolo: 0
Celle galvaniche - dispositivo, principio di funzionamento, tipi e caratteristiche principali
Prerequisiti per la comparsa di celle galvaniche. Un po 'di storia. Nel 1786, il professore di medicina italiano, il fisiologo Luigi Aloisio Galvani scoprì un fenomeno interessante: i muscoli delle zampe posteriori di un cadavere appena aperto di una rana sospesa su ganci di rame si contrarono quando lo scienziato li toccò con un bisturi d'acciaio. Galvani concluse immediatamente che si trattava di una manifestazione di "elettricità animale".
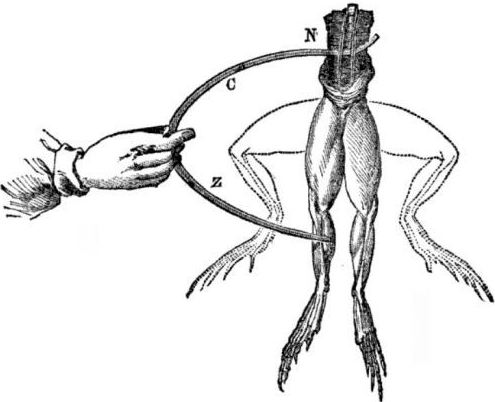
Dopo la morte di Galvani, il suo contemporaneo Alessandro Volta, come chimico e fisico, descriverà e dimostrerà pubblicamente un meccanismo più realistico per la presenza di corrente elettrica quando diversi metalli entrano in contatto.
Volta, dopo una serie di esperimenti, giungerà alla conclusione inequivocabile che la corrente appare nel circuito a causa della presenza in esso di due conduttori di metalli diversi posti in un liquido, e questa non è affatto "elettricità animale", come pensava Galvani. La contrazione delle zampe della rana è stata una conseguenza dell'azione della corrente derivante dal contatto di vari metalli (ganci di rame e un bisturi d'acciaio).
Volta mostrerà gli stessi fenomeni che Galvani mostrò su una rana morta, ma su un elettrometro fatto in casa completamente inanimato, e nel 1800 fornirà una spiegazione accurata della corrente: “il conduttore di seconda classe (liquido) è nel mezzo ed è in contatto con due conduttori di prima classe di due diversi metalli ... Di conseguenza, sorge una corrente elettrica in una direzione o nell'altra. "

In uno dei primi esperimenti, Volta ha abbassato due piastre - zinco e rame - in un barattolo di acido e le ha collegate con un filo. Successivamente, la piastra di zinco ha iniziato a dissolversi e si sono formate bolle di gas sull'acciaio di rame. Volta ha suggerito e dimostrato che la corrente elettrica scorre attraverso il filo.
Fu così inventato l '"elemento Volta" - la prima cella galvanica. Per comodità, Volta gli ha dato la forma di un cilindro verticale (pilastro), costituito da anelli interconnessi di zinco, rame e tessuto impregnati di acido. Un palo di volt alto mezzo metro ha creato una tensione sensibile all'uomo.
Fin dall'inizio della ricerca fu posto il nome Luigi Galvani fonte di corrente chimica conservò il ricordo di lui nel suo nome.
Cella galvanica È una fonte chimica di corrente elettrica, basata sull'interazione di due metalli e / o dei loro ossidi in un elettrolita, che porta alla comparsa di una corrente elettrica in un circuito chiuso. Pertanto, nelle celle galvaniche, l'energia chimica viene convertita in energia elettrica.
Cells Today

Le cellule oggi si chiamano batterie. Sono diffusi tre tipi di batterie: salino (secco), alcalino (sono anche chiamati alcalini, "alcalini" nella traduzione dall'inglese - "alcalini") e al litio. Il principio del loro lavoro è lo stesso descritto da Volta nel 1800: due metalli interagire attraverso l'elettrolitoe una corrente elettrica sorge in un circuito chiuso esterno.
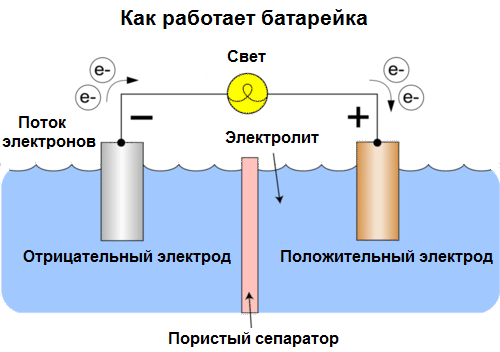
La tensione della batteria dipende dai metalli utilizzati e dal numero di celle nella "batteria". Le batterie, a differenza delle batterie, non sono in grado di ripristinare le loro proprietà, poiché convertono direttamente l'energia chimica, cioè l'energia dei reagenti (riducente e ossidante) che compongono la batteria, in energia elettrica.
I reagenti inclusi nella batteria vengono consumati durante il suo funzionamento, la corrente diminuisce gradualmente, quindi l'azione della sorgente termina dopo che i reagenti hanno reagito completamente.
Gli elementi alcalini e salini (batterie) sono ampiamente utilizzati per alimentare una varietà di dispositivi elettronici, apparecchiature radio, giocattoli e litio che si trovano più spesso in dispositivi medici portatili come misuratori di glicemia o in tecnologie digitali come fotocamere.

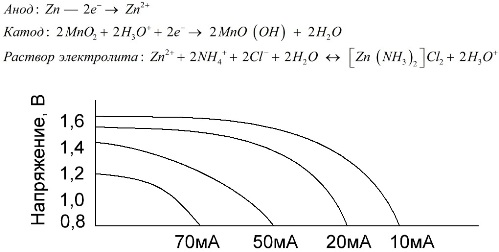
Batterie al sale
Le celle di zinco-manganese, chiamate batterie al sale, sono celle galvaniche "a secco", all'interno delle quali non esiste una soluzione elettrolitica liquida.
Un elettrodo di zinco (+) è un catodo a forma di coppa e una miscela polverosa di biossido di manganese e grafite funge da anodo. La corrente scorre attraverso un'asta di grafite. Come elettrolita, una pasta viene utilizzata da una soluzione di cloruro di ammonio con l'aggiunta di amido o farina per addensare, in modo che non scorra nulla.
In genere, i produttori di batterie non indicano l'esatta composizione degli elementi salati, tuttavia le batterie al sale sono le più economiche, di solito vengono utilizzate in dispositivi in cui il consumo energetico è estremamente basso: in ore, nei telecomandi, nei termometri elettronici, ecc.

Il concetto di "capacità nominale" è usato raramente per caratterizzare le batterie al manganese-zinco, poiché la loro capacità dipende fortemente dalle condizioni operative. I principali svantaggi di questi elementi sono un tasso significativo di riduzione della tensione durante la scarica e una riduzione significativa della capacità di uscita con l'aumento della corrente di scarica. La tensione di scarica finale viene impostata in base al carico nell'intervallo di 0,7-1,0 V.
Non solo l'entità della corrente di scarica è importante, ma anche il calendario del carico. Con scariche intermittenti di grandi e medie correnti, le prestazioni delle batterie aumentano notevolmente rispetto al funzionamento continuo. Tuttavia, con piccole correnti di scarica e mesi di interruzioni durante il funzionamento, la loro capacità può diminuire a causa dell'autoscarica.
Il grafico sopra mostra le curve di scarica per una batteria al sale media per 4, 10, 20 e 40 ore per il confronto con una batteria alcalina, che sarà discussa più avanti.
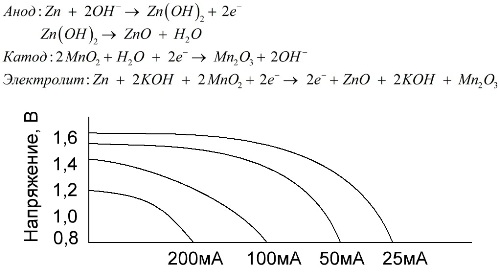
Batterie alcaline (alcaline)
Una batteria alcalina è una batteria galvanica di manganese-zinco, in cui il biossido di manganese viene utilizzato come catodo, lo zinco in polvere viene utilizzato come anodo e una soluzione alcalina viene utilizzata come elettrolita, solitamente sotto forma di una pasta di idrossido di potassio.
Queste batterie presentano numerosi vantaggi (in particolare, una capacità significativamente maggiore, prestazioni migliori a basse temperature e correnti di carico elevate).

Le batterie alcaline, rispetto a quelle al sale, possono fornire più corrente per lungo tempo. Una corrente maggiore diventa possibile perché lo zinco qui non viene utilizzato sotto forma di un vetro, ma sotto forma di una polvere avente un'area di contatto più ampia con l'elettrolita. L'idrossido di potassio sotto forma di pasta viene utilizzato come elettrolita.
È grazie alla capacità di questo tipo di celle galvaniche di fornire una corrente significativa (fino a 1 A) per lungo tempo, al momento le batterie alcaline sono più comuni.
Nei giocattoli elettrici, nelle apparecchiature mediche portatili, nei dispositivi elettronici, nelle macchine fotografiche, le batterie alcaline sono utilizzate ovunque. Servono 1,5 volte più a lungo della soluzione salina se la scarica è a bassa corrente. Il grafico mostra le curve di scarica a diverse correnti per il confronto con una batteria al sale (il grafico è stato fornito sopra) per 4, 10, 20 e 40 ore.
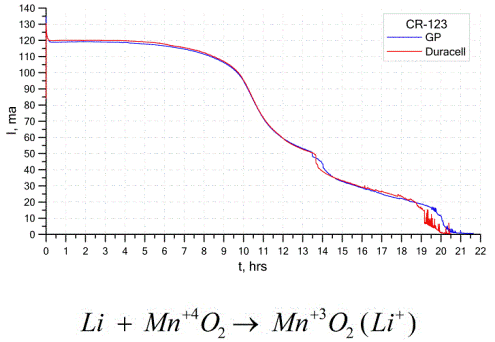
Batterie al litio
Un altro tipo abbastanza comune di celle galvaniche sono le batterie al litio - singole celle galvaniche non ricaricabili in cui il litio o i suoi composti sono usati come anodo. A causa dell'uso del metallo alcalino, hanno un'alta differenza di potenziale.

Il catodo e l'elettrolita di una cellula al litio possono essere molto diversi, quindi il termine "cellula al litio" combina un gruppo di cellule con lo stesso materiale anodico.Come catodo, ad esempio, possono essere usati biossido di manganese, monofluoruro di carbonio, pirite, cloruro di tionile, ecc.
Le batterie al litio si distinguono dalle altre batterie per l'elevata autonomia e il costo elevato. A seconda delle dimensioni e dei materiali chimici utilizzati, una batteria al litio può produrre tensioni da 1,5 V (compatibile con batterie alcaline) a 3,7 V.
Queste batterie hanno la massima capacità per unità di massa e una lunga durata. Le celle al litio sono ampiamente utilizzate nelle moderne apparecchiature elettroniche portatili: per alimentare orologi su schede madri di computer, per alimentare dispositivi medici portatili, orologi, calcolatrici, in attrezzature fotografiche, ecc.
Il grafico sopra mostra le curve di scarica di due batterie al litio di due noti produttori. La corrente iniziale era di 120 mA (per resistenza dell'ordine di 24 Ohm).
Vedi anche: Moderne batterie ricaricabili: vantaggi e svantaggi
Vedi anche su electro-it.tomathouse.com
: